
News & Trends
Der Katzenschreck und weitere Gadgets aus der Zukunft
von Aurel Stevens

«Mit dieser Batterie hält dein Smartphone eine Woche lang durch!», «Neuer Akku in 15 Minuten geladen!» Kommen dir diese Sätze bekannt vor? Eben. Gefühlt jeden Monat liest man von einer Wunder-Batterie, die wirklich, wirklich bald kommt. Zeit für einen Reality-Check.
Anfang 2016 stellten Philipp Rüegg und ich die bescheidene Redaktion von digitec und Galaxus. In einer meiner ersten Storys ging es um den Mobile World Congress (MWC) in Barcelona. Heute sind wir zu fünfzehnt und Dominik Bärlocher hat sich die Smartphone-Welt zur Brust genommen. Und macht das viel besser als ich. Aber darum geht’s gar nicht. Damals stellte die Firma MyFC den JAQ vor: Eine auswechselbare Brennstoffzelle, mit der Smartphones dank handlicher Cartridges ohne Steckdose aufgeladen werden. Cool!
Und, was ist jetzt – zwei Jahre später – aus dem JAQ geworden? Es gibt eine Menge neuer Pressemitteilungen. In der freien Wildbahn kann man das Produkt leider noch immer nicht bestaunen. Genau so wenig wie das NEC-Notebook mit Brennstoffzelle, das schon vor 15 Jahren als Prototyp vorgestellt wurde.
Ist die Brennstoffzelle deshalb tote Technologie? Natürlich nicht. Der Automobilhersteller Toyota setzt gerade sehr viel auf diese Karte. Zwar noch nicht mit durchschlagendem Erfolg, dafür mit guten Gründen. Die Brennstoffzelle ist nach wie vor ein sehr interessanter portabler Energiespeicher, der das Rennen machen könnte.
Die Automobil-Industrie ist ein gutes Stichwort: Das ohnehin schon riesige Bedürfnis nach immer besseren Energiespeichern und insbesondere Akkus wird von Tesla & Co. beflügelt. Ebenso wie von der Photovoltaik, die in immer grösserem Massstab eingesetzt wird und preislich immer attraktiver wird. Die Welt wartet händeringend auf die nächste Akku-Generation. Du doch auch, oder?
Drum gibt’s zuerst eine Ladung Theorie – damit du in Zukunft weisst, wann du bei Jubelmeldungen («Neues Akku-Wunder!») das Kleingedruckte («in einigen Jahren marktreif») erwarten kannst. Denn oft werden Zwischenschritte in der Forschung oder Wundermaterialien als «The Next Big Thing» präsentiert.
Beispiel gefällig?

Quelle: Computerbild
..und das Kleingedruckte ganz am Ende des Artikels (wo sonst):
Wann die mit Graphen ausgestatteten Akkus erstmals in Masse produziert werden und in einem Endprodukt zum Einsatz kommen, ist ungewiss.
Ganz allgemein werden Forschungsergebnisse aus dem Labor von der Presse gerne übertrieben optimistisch dargestellt, weil es eine hübsche Headline abgibt. In der Realität werden die allermeisten Konzepte verworfen. Die Misserfolge werden logischerweise nicht an die grosse Glocke gehängt. Trotzdem ist diese Forschung nicht vergebens; schliesslich ist auch wichtig zu wissen, was nicht funktioniert.
A propos Forschung: Batterie-Entwicklung braucht einen ausgesprochen langen Atem. Der Weg vom Labor bis zum Onlineshop dauert ein Jahrzehnt und länger. Nur schon der Aufbau einer effizienten Fertigungsstrasse dauert mehrere Jahre. Die Hersteller der Endgeräte müssen ihre Produkte, Ladegeräte und Prozesse anpassen. Behörden verlangen ausführliche Sicherheitsüberprüfungen. Und so weiter. Der weltgrösste Autozulieferer Bosch hat sich gerade Ende Februar 2018 gegen die Fertigung eigener Zellen entschieden – zu teuer.
Neue Akkus müssen natürlich auch etwas deutlich besser können. Sonst hat man ja keinen Anlass, diesen extrem teuren Spiessrutenlauf zu machen. Sie müssen eine Vielzahl an Eigenschaften für den jeweiligen Einsatzzweck möglichst ideal erfüllen:
..puh! So ein Akku muss eine ganze Menge können.
Je nach Anwendungszweck stehen andere Eigenschaften im Vordergrund. Autobatterien sind bis heute Akkus, die mit Blei und Schwefelsäure funktionieren. Weil das günstig ist und es auf ein paar Kilo mehr nicht drauf ankommt. Oder Hausbatterien, in denen Solarstrom gespeichert werden soll: Diese Akkus sind im Keller und es macht nichts, wenn sie eher viel Platz brauchen und dafür billiger sind. Für mobile Geräte hingegen muss es besonders kompakt und möglichst leicht sein.
Das Komplizierte ist: Optimiert man einen Akku auf eine Eigenschaft hin, leidet fast immer eine andere. Das lässt sich schön am obigen Beispiel von Samsung zeigen: Zwar kann der Graphen-Akku rasend schnell geladen werden und hat dank des neuen Wundermaterials eine höhere Kapazität. Allerdings geht das auf Kosten der Grösse: Die volumetrische Dichte von Graphen-Bällen ist deutlich höher als von konventionellem Graphit. (Der verlinkte Artikel stammt übrigens aus der Feder eben jener Samsung-Forscher, über deren Erkenntnisse die Computerbild berichtet.)
Damit du dich von solchen Schlagzeilen nicht übers Ohr hauen lässt, musst du die Stellschrauben kennen, mit denen wirkliche Fortschritte erzielt werden. Dazu musst du verstehen, wie und warum ein Akku funktioniert. Ein wenig mehr Theorie braucht es noch: Wir machen einen Abstecher direkt in die Elektrochemie. Läuft es dir schon kalt den Rücken runter? Keine Angst, es wird zwar kompliziert, ich beschränke mich aber aufs Wesentliche.
Das Funktionsprinzip jeder Batterie und jedes Akkus ist schnell erklärt: Hängst du einen Verbraucher – etwa eine Glühbirne – an eine Batterie, wird die gespeicherte chemische Energie in elektrische Energie verwandelt. Im Unterschied zur Wegwerf-Batterie kann der Akku das Kunststück auch in die andere Richtung: Elektrische Energie wird in chemischer Energie gespeichert.
Es gibt verschiedene Konzepte und Materialien, um das zu bewerkstelligen. Es kommen aber immer dieselben Bauteile zum Einsatz: zwei Elektroden, ein Elektrolyt und ein Separator. Erst ein angeschlossener Verbraucher bringt die chemische Reaktion in Gang, indem er den Stromkreis schliesst und so den Elektronenfluss erlaubt.
Die eine Elektrode wird Anode genannt, die andere Kathode. Die Anode ist beim Entladen der Minuspol, die Kathode der Pluspol. Beim Laden tauschen die Pole, darum sind die Begriffe Anode und Kathode präziser. Die Anode erwünscht eine chemische Reaktion, die sehr gerne Elektronen abgibt. Dabei werden positiv geladene Atome – eben Ionen! – hinterlassen. Die Ionen wollen unbedingt wieder einen neutralen Zustand einnehmen. Sie wandern in den Elektrolyten. Die Kathode ihrerseits nimmt sehr gerne Elektronen auf und reagiert in ein anderes Molekül. Die Ionen werden durch den Separator gezogen und wieder eingegliedert.
Die Differenz dieses Verlangens nach einer Reaktion in ein anderes Molekül wird Spannung genannt, die in Volt gemessen wird. Welches Potenzial geeignete Moleküle haben, kann man in Spannungsreihen nachschauen. Wenn du die verlinkte Tabelle studierst, siehst du, warum Lithium so interessant ist.
In der Batterie spielen zwei miteinander kompatible Reaktionspaare mit: Von der Anode zur Kathode fliessen Elektronen und die Reaktionen auf beiden Seiten müssen mit denselben Ionen interagieren wollen. Die Anode gibt Elektronen ab und hinterlässt Ionen. Dieser chemische Prozess wird Oxidation genannt. Die Kathode nimmt Elektronen auf und bindet die Ionen, das wird Reduktion genannt. Beide zusammen nennt man in der Chemie Redox-Reaktion. Es sind also zwei (!) Paare von chemischen Reaktionen, die als Gesamtsystem interagieren: die Redox-Paare.
Die chemischen Reaktionen finden in der Zelle statt, solange es an beiden Elektroden Moleküle hat, die noch Elektronen abgeben oder aufnehmen wollen. Sobald eine der Elektroden keine Moleküle anzubieten hat, die Elektronen und Ionen abgeben bzw. aufnehmen und binden können, stoppt der Prozess. Oder anders gesagt: Die Batterie ist leer. Der Clou ist, dass der Akku die chemische Reaktion rückwärts durchführt, wenn man Elektronen zuführt.
Wäre Elektrizität wie Wasser, dann wäre die Spannung das Gefälle zwischen beiden Polen: Der eine Punkt liegt sehr hoch, der andere sehr tief. Deshalb wollen die Elektronen zum anderen Pol «herunterfliessen». Die Stromstärke hingegen wird davon bestimmt, wie viele Elektronen tatsächlich fliessen. Die Stromstärke wird in Ampere gemessen. Nochmals die Wasser-Analogie: Ob du ein Bächlein oder einen reissenden Strom vor dir hast, wird dadurch bestimmt, wie stark der Druck ist, wie steil das Gefälle ist (Volt) und wie viel Wasser fliesst (Ampere). Das Produkt von Volt × Ampere ist die Leistung in Watt. Leistung × Zeiteinheit (mAh, Wh) ist Energie.
Dieser Zusammenhang ist wichtig: Bei deinem Handy oder Notebook wird die Kapazität meist in Milliamperestunden (mAh) angegeben. Anhand obiger Formel weisst du, dass mAh nicht viel aussagt, wenn du die Zellspannung in Volt nicht kennst. Beispiel: Du hast einen Nickel-Cadmium-Akku mit 1000 mAh und einen Lithium-Ionen-Akku mit 500 mAh. Welcher hat mehr Kapazität? Der NiCd-Akku hat eine Nominalspannung von 1.2 Volt. Der Lithium-Ionen-Akku 3.6 Volt. Analog obiger Formel gilt: Wattstunde = Volt × mAh. Das ganze dividiert durch 1000, weil wir mit Milliamperestunden hantieren. Somit hat der NiCd-Akku 1.2 Wattstunden Energie gespeichert, der Li-Io-Akku 1.8 Wattstunden!
Die Spannung verändert sich mit dem Ladezustand des Akkus: Voll geladen ist sie deutlich höher als wenn der Akku fast leer ist. Bei der Autobatterie etwa verändert sie sich je nach Ladezustand zwischen 1,75 und 2,4 Volt. Die gewünschte Spannung hat Auswirkungen auf den Aufbau des Akkus. Die Autofahrer unter den Lesern wissen, dass eine Autobatterie nicht 2 Volt hat, sondern 12 Volt. In der Autobatterie sind deshalb 6 Zellen in Serie geschaltet. So addiert sich die Spannung auf 12 Volt. Oder genauer gesagt auf einen Wert zwischen etwa 10.5 V und 14.4 V. Die Zellspannung ist übrigens einer von mehreren Mechanismen, um den Ladezustand zu ermitteln.

Aufgesägter Blei-Akku: Die sechs Zellen summieren sich zu einer Spannung von ca. 12 Volt. Bild: Wikipedia/Ben Cossalter
Zellen lassen sich nicht nur in Serie schalten, sondern können auch parallel verbunden werden: Damit erhöht man anstatt die Spannung die Kapazität. Auch das siehst du im obigen Bild sehr gut: Innerhalb jeder Zelle sind Sandwiches von Blei- und Bleioxidplatten gestapelt.
Lade- und Entladevorgänge können nicht unendlich wiederholt werden, wie du am Bild des sehr alten Blei-Akkus schön siehst: An den einst blitzblanken Elektroden haben sich mit der Zeit immer grössere PbSO₄-Kristalle festgesetzt. Sie verkleinern die elektrochemisch aktive Oberfläche stark – die Kapazität schwindet.
Beim Lithium-Ionen-Akku passieren ganz ähnliche Vorgänge, die den Akku langfristig schädigen: Beim Laden bildet sich an der Anode mit der Zeit ein Film, der die Oberfläche des Graphits bedeckt. An dieser Stelle kann das Graphit nicht mehr mit dem Elektrolyt und den Ionen darin interagieren; die Kapazität schwindet. Auch die Kathode des Li-Io-Akkus leidet an einem Effekt, der Elektrolyt-Oxidation genannt wird. Das passiert gerne bei einer hohen Zellspannung, also wenn die Zelle ganz geladen ist. Lithium-Ionen-Akkus gelten als verbraucht, wenn sie nur noch 80 Prozent ihrer ursprünglichen Kapazität haben – denn ab diesem Zeitpunkt altert der Akku immer schneller.
Zusammengefasst: Viele chemische Reaktionen laufen nicht vollständig ab. Insbesondere wenn der Akku ganz leer oder ganz voll ist, verstärken sich diese negativen Effekte bei vielen Typen. Sehr tiefe oder sehr hohe Temperaturen und zu schnelles Laden oder Entladen beschleunigen diese unerwünschten Vorgänge im Akku. Die Effektivität der chemischen Reaktion wird Coulomb- oder Faraday-Effizienz genannt.
Im Labor versucht man diese Kollateralschäden zu minimieren. Das gelingt einerseits durch neue Materialien oder zum Beispiel durch Additive, die dem Elektrolyten beigefügt werden. Es ist auch der Grund, weshalb die Anode vieler Akkus mit Graphit bedeckt ist; so wird das Lithium nicht direkt dem Elektrolyten exponiert und nimmt so viel langsamer Schaden.
Jetzt weisst du, wo die Stellschrauben sind: Bei der Akkuforschung geht es immer darum, ...
Ausgestattet mit diesem neuen Fundus an Wissen geht’s endlich ans Eingemachte! An welchen Akku-Technologien wird geforscht – und was macht sie so vielversprechend?
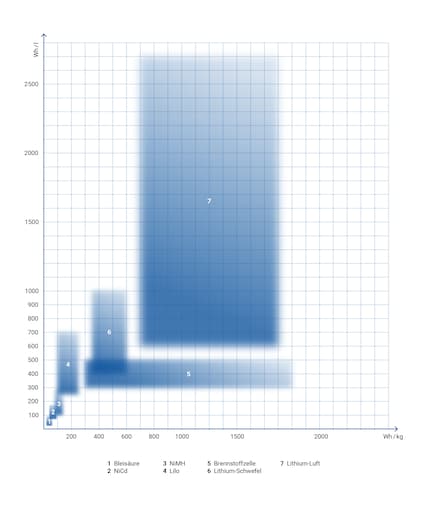
Energiedichten verschiedener Speicher. Grafik: Sven Mathis
Die Grafik ist stark vereinfacht: Die Energiedichte kann nicht wirklich als Rechteck abgebildet werden. Du musst dir eher Punkte von Vertretern eines Typs vorstellen. Es gibt nicht den NiMH-Akku und nicht den Lithium-Ionen-Akku, sondern verschiedene Varianten davon. Durch Forschung wird jeder Typ weiterentwickelt, so dass moderne Varianten eines Typs eher rechts oder eher oben angesiedelt sind – im Idealfall möglichst weit oben rechts. Bei aufstrebenden Technologien wie Lithium-Schwefel befinden wir uns also erst in der unteren linken Ecke, während die rechte obere Ecke das ungefähr prognostizierte Maximum darstellt. Ich habe mich an geschätzten Praxiswerten orientiert, nicht am theoretischen Maximum.
An der Grafik kannst du sehr schön die Historie der Akku-Entwicklung ablesen:
Würde man die Energiedichten mit denen von Benzin oder Diesel vergleichen – die Grafik würde ganz anders aussehen: Alle Akkus wären unten links gedrängt – Benzin trumpft mit 13 000 Wh pro Liter auf. Zoomt man nochmals heraus, ist alles vorherige nur ein Pixel unten links: Die Kernspaltung schlägt mit millionenfach höherer Energiedichte alles.
Lithium-Ionen-Akkumulator
Der Lithium-Ionen-Akkumulator ist der dominante Energiespeicher. Er hat gegenüber seinen Vorläufern entscheidende Vorteile. Der Memory-Effekt ist kaum mehr vorhanden: Akkus müssen nicht mehr vollständig geladen und entladen werden. Im Alltag ein unschätzbarer Vorteil. Er ist ausserdem kleiner, umweltverträglicher und günstiger. Er leidet geringer an Selbstentladung als etwa NiMH-Akkus, die an die 20 Prozent pro Monat verlieren.
Den Lithium-Ionen-Akku gibt es nicht, vielmehr etliche Bauarten davon. Alle zeichnen sich dadurch aus, dass sie eine gute Energiedichte haben, die Selbstentladung gering ist und moderne Varianten einige hundert Ladezyklen überstehen. In der Anwendung sind sie hinreichend sicher, wenn man sie nicht quetscht, wie es Samsung beim Note 7 gemacht hat: Das Graphit an der Kathode wird durch die Aufnahme der Lithium-Ionen ausgedehnt. Steht der Platz dafür nicht zur Verfügung, platzt der Akku und das extrem reaktionsfreudige Lithium reagiert mit dem Rest des Akkus.
Der Lithium-Ionen-Akku hat aber auch grosse Nachteile: Er verträgt Wärme schlecht und geht bei Hitze sehr schnell kaputt. Bei Temperaturen unter 0° Celsius kann er nicht geladen werden. Tiefentladung zerstört ihn. Deshalb findest du, wenn du ihn auseinander nehmen würdest, ordentlich Elektronik und sogar einen Temperatursensor. Die Elektronik hilft dabei, dass der Akku innerhalb sicherer Parameter betrieben wird und keinen Schaden nimmt. Sie ist teilweise schuld daran, dass ein Li-Io-Akku pro Monat etwa 3-5 Prozent seiner Ladung verliert, ohne dass du ihn benutzt.
Einfach damit es gesagt ist: Nimm keine Batterien und Akkus auseinander, das kann gefährlich sein! Deshalb ein Blick in einen (austauschbaren) Notebook-Akku:

Bei den braunen Drähten handelt es sich um den Temperatursensor. Hier siehst du sehr schön, wie die einzelnen Zellen sowohl in Serie als auch parallel geschaltet sind. Viele Notebook-Akkus sind aus 18650er-Zellen aufgebaut. Quelle: Wikipedie/Lead holder
Erinnerst du dich noch an Merkmale und Eigenschaften von Akkus zum Eingang des Artikels? Genau deshalb gibt es Lithium-Ionen-Akkus in den unterschiedlichsten Ausprägungen. Mal wird auf maximale Sicherheit geachtet, mal auf hohe Zyklenfestigkeit. In deinem Smartphone steckt fast immer Technologie mit Kobalt, genauer LiCoO₂ (LCO). Es ist der zuerst entwickelte Typ und seine Leistung wurde seit 1991 mehr als verdoppelt. Einfach mal zum Vergleich die anderen geläufigen Varianten:
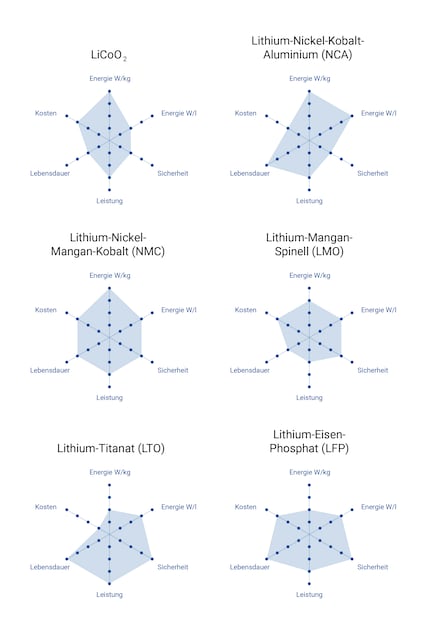
Eckdaten verschiedener Lithium-Ionen-Speicher. Je höher der Balken, desto besser der Wert. Quellen: Boston Consulting Group, batteryuniversity.com. Grafik: Sven Mathis
Lithium-Polymer-Akkus
Lithium-Polymer-Akkus oder kurz LiPos kennst du vielleicht aus ferngesteuerten Fahrzeugen. Eigentlich sollten sie Lithium-Ionen-Polymer-Akku genannt werden. Denn elektrochemisch unterscheiden sie sich nicht grundsätzlich von ihren obigen Verwandten. Der Unterschied liegt im Elektrolyt: Bei herkömmlichen Li-Io-Akkus ist er flüssig, bei Polymer-Akkus fest. Polymere sind fädige, aneinandergereihte Makromoleküle. Sie kommen auch natürlich vor. Deine Haare bestehen zum Beispiel aus Polymeren. Polymere werden auch künstlich hergestellt. Im LiPo sind das gelatinöse, schwabblige Stoffe, und zwar solche, die elektrisch gut leitfähig sind und viele Ionen aufnehmen können.
Der feste Elektrolyt hat praktische Vorteile: Dank ihrer Eigenstabilität können LiPos in verschiedensten Formen hergestellt werden. Sie benötigen eine weniger stabile Hülle; eine dünne und leichte Folie reicht. Du weisst vielleicht, dass RC-Akkus als besonders heikel gelten. Werden sie verletzt oder überladen, dann blähen sie sich auf und fangen rasch Feuer. Modellbauer laden und lagern ihre Lithium-Polymer-Akkus deshalb in feuersicheren Beuteln, damit die Wohnung nicht abgefackelt wird.
Das ist aber nur so, weil die Sicherheit gegen Energiedichte getauscht wurde. Die Sicherheitselektronik wurde aus Gewichtsgründen ebenfalls weggespart und ins Ladegerät ausgelagert. Rein prinzipiell können Lithium-Polymer-Akkus genauso sicher wie Lithium-Ionen-Akkus gebaut werden. Im Macbook Pro, auf dem ich gerade tippe, ist ein LiPo mit sechs Zellen verbaut.
Lithium-Metall
Lithium-Metall gilt als vielversprechender Nachfolger der Lithium-Ionen-Technik. In der Praxis ist Lithium-Metall bereits anzutreffen – aber eben nicht als wiederaufladbare Variante. Als Beispiel seien Lithium-Knopfzellen genannt. Lithium-Metall verspricht eine doppelt so hohe Energiedichte gegenüber Li-Io-Akkus bei geringer Selbstentladung. Der Ansatz ist, dass das Lithium ohne Graphit-Schicht direkt dem Elektrolyten exponiert wird. Dadurch ist die chemisch aktive Oberfläche sehr gross. Das bedeutet hohe Kapazität und schnelles Laden. Der Lithium-Metall-Akku kann durch das Weglassens des Graphits kompakter gebaut werden.
Wiederaufladbare Lithium-Metall-Akkus sind noch nicht praxisreif. Denn die direkt exponierten Metalle bilden mit jedem Zyklus sogenannte Dendriten. Das sind Ablagerungen, die wie ein Stalagmit in den Elektrolyten hineinwachsen und sogar den Separator durchstossen können. Sobald das passiert, schliesst sich der Akku kurz. Der Durchbruch in der Forschung ist erreicht, wenn diese Dendritenbildung verhindert oder stark verlangsamt wird.
Feststoff-Akkus
Von Feststoff-Akkus oder englisch Solid-state batteries ist derzeit wieder öfter zu lesen. Eigentlich sind sie nur ein Baustein, um Lithium-Metall-Akkus zu ermöglichen. Die Idee ist, dass der Elektrolyt nicht flüssig ist, sondern aus einem porösen oder kristallinen Material besteht. Der feste Elektrolyt löst das Problem der Dendritenbildung. Er kann auch dünner ausfallen als das Sandwich Flüssigelektrolyt – Separator – Flüssigelektrolyt. Das erlaubt viel flexiblere Bauformen, etwa als dünne Folie. In der Tendenz sollen Feststoff-Akkus eine längere Lebensdauer aufweisen. Sie sind sicherer, weil kein Elektrolyt austreten kann.
Mittlerweile kennst du ja das Spiel: Wogegen wurden obige Eigenschaften eingetauscht? Auf der negativen Seite ist die geringere Leistung zu vermerken. Die bisher bekannten festen Elektrolyten leiten Ionen weniger gut als ihre flüssigen Pendants. Das heisst, das Laden geht eher länger und beim Entladen können weniger hohe Ströme entnommen werden. Gegenwärtige Ausführungen kommen mit tiefen Temperaturen weniger gut klar. Prototypen halten erst wenige hundert Zyklen durch. Und schliesslich: Aktuelle Feststoff-Elektrolyten sind wahnsinnig teuer. Eine Feststoff-Autobatterie würde zehntausende Franken kosten.
Lithium-Schwefel
Der Lithium-Schwefel-Akku gilt als möglicher Nachfolger mit hohem Potenzial. An ihm wird seit den 1960er-Jahren gepröbelt. Die Energiedichte gegenüber Li-Io-Akkus wird in etwa verdreifacht. Obendrein sind sowohl Lithium als auch Schwefel leichte Elemente. Die chemische Reaktion gelingt auch bei tiefen Temperaturen, das Aufladen funktioniert gar bis -60° Celsius. Ökologisch ist der Akku unbedenklich und Schwefel ist im Überfluss vorhanden.
Genau wie beim Lithium-Metall-Akku verzichtet man bei Lithium-Schwefel auf das Graphit an der Anode, das spart Gewicht und Platz. An der Kathode wird das Metalloxid durch billiges und leichteres Schwefel ersetzt. Die chemische Reaktion ist ausserdem effizient, weil pro Molekül gleich zwei Lithium-Ionen andocken können.
Im Labor werden bereits sehr hohe Werte erreicht, was Energiedichte und Leistung angeht. Allerdings gehen dahingehend optimierte Prototypen noch rasend schnell kaputt: Es sind nur wenige dutzend Zyklen möglich. In den letzten fünf Jahren haben Forscher die Zyklen auf über 4000 hochgeschraubt, dies aber auf Kosten der Energiedichte und Leistung.
Lithium-Luft
Am Lithium-Luft-Akku wird seit den 70er-Jahren geforscht. Er ist der heilige Gral der Akku-Forschung. Das hat zwei Gründe. Erstens spart man eine Menge Platz, da einer der Reaktionsbestandteile (O₂) nicht im Akku eingebaut werden muss, sondern aus der Umwelt aufgenommen wird. Zweitens hat der Lithium-Luft-Akku eine theoretische Energiedichte von unglaublichen 13 kWh pro Kilo, gleich viel wie Benzin. In der Praxis sollen etwa 2800 Wh/kg erreicht werden. Da der Verbrennungsmotor mit einem Wirkungsgrad von um die 30 Prozent ziemlich ineffizient ist, wäre ein Lithium-Luft-Akku in einem E-Auto (Wirkungsgrad: 90 Prozent) revolutionär.
Es wird vermutlich noch sehr lange dauern, bis die Lithium-Luft-Batterie kommt. Etliche Forscher bezweifeln angesichts der vielfältigen Probleme, dass sie überhaupt den Massenmarkt erreichen wird.
Natrium-Ionen
Beim Natrium-Ionen-Akku (Englisch: Sodium-Io) wird das Lithium durch Natrium ersetzt. Die Energiedichte ist ziemlich mies und liegt bei etwa 90 Wh/kg. Solche Akkus würden also sehr gross und schwer sein. Für Anwendungen, wo Platz und Gewicht keine Rolle spielen, ist er trotzdem interessant: Natrium steht praktisch unlimitiert zur Verfügung und somit sehr günstig. Es ist auch sicherer als Lithium. Die chemische Reaktion ist zudem immun auf Tiefentladung.
Weiterentwicklungen mit Graphen

Graphen. (Quelle: Wikipedia/AlexanderAlUS)
Bislang wird in Li-Io-Akkus an den Elektroden Graphit verwendet. Graphit ist eine Form reinen Kohlenstoffs, genau wie Diamant – die beiden haben einfach eine andere atomare Struktur. Graphen ist ebenfalls reiner Kohlenstoff, der aber zweidimensional in einem sechseckigen, bienenwabenförmigen Muster angeordnet ist. Graphen regt zum Träumen an. Das Material hat erstaunliche Eigenschaften; es ist etwa 125 Mal zugfester als Stahl. Es ist härter als Diamant. Es lässt sich rollen. Es ist transparent. Es ist flüssigkeitsundurchlässig. Und es ist elektrisch extrem leitfähig.
Die letzte Eigenschaft macht den Stoff für Akkus interessant. Wird die Anode mit einer Schicht Graphen überzogen, so lebt die Anode dank der Stabilität von Graphen obendrein deutlich länger. Als Kathodenmaterial würde sich dank der grossen Oberfläche die Ladezeit drastisch verkürzen und die Kapazität massiv erhöhen.
In der Theorie sind mit Graphen viel bessere Akkus möglich. Würde. Hätte. Das Hype-Potenzial von Graphen ist direkt proportional zu den Eigenschaften des Wundermaterials. Das Problem ist, dass sich Graphen nur schwer in Reinform und in grösseren Mengen herstellen lässt. Es wird voraussichtlich noch mehr als 10 Jahre dauern, bis Graphen in deinen Akkus steckt.
Brennstoffzelle
Brennstoffzellen gibt es in den unterschiedlichsten Varianten. Sie funktionieren mit Alkoholverbindungen, Glukoselösungen oder komprimierten Wasserstoff. Allen gemein ist, dass sie – im Unterschied zu einem Verbrennungsmotor – die chemische Energie mit Hilfe eines Oxidationsmittels direkt in elektrische Energie umwandeln. In diesem Sinne ist «Brenn»stoff-Zelle etwas irreführend.
Die geläufigste Variante ist die Wasserstoff-Sauerstoff-Brennstoffzelle. Sie hat den Vorteil, dass einer der nötigen Reaktionsbestandteile, das Oxidationsmittel, aus der Umgebung aufgenommen werden kann: Sauerstoff. Das Produkt der chemischen Reaktion ist H₂O. Das «Abgas» aus dem Auspuff ist Wasser. Das klingt wahnsinnig sauber. Lokal ist die Brennstoffzelle denn auch ein Sauberkeitswunder: Sie würde Abgasprobleme in Städten komplett lösen.
Global betrachtet ist die Brennstoffzelle kein ökologisches Wunder, weil der Gesamtprozess von der Herstellung von Knallgas oder Methanol bis zur Umwandlung in elektrische Energie ziemlich ineffizient ist. Der Wirkungsgrad der gesamten Kette von der Herstellung bis zur Umwandlung liegt bei etwa 60 Prozent. In Regionen, wo regenerative Energien im Überfluss vorhanden sind, fällt dieser Nachteil weniger ins Gewicht.
Die Brennstoffzelle ist in kommerziellem Betrieb. Die Miniaturisierung ist nahe an der Realität. Der grösste Stolperstein ist die notwendige Infrastruktur. Erschwerend kommt hinzu: Je vielversprechender neue Akku-Technologien, desto uninteressanter wird die ineffiziente Brennstoffzelle.
Ups. Jetzt ist der Artikel etwas länger geworden als ursprünglich geplant. Immerhin weisst du jetzt, wie ein Akku funktioniert und in welcher Grössenordnung du Verbesserungen erwarten kannst. Es bleibt spannend und einige der beschriebenen Ansätze sind schon beinahe greifbar. Und wer weiss – vielleicht schlägt ein neues Startup einen ganz neuen Weg ein. Gerade beim letzten Punkt hast du nun den Hintergrund, um die Technologie einzuschätzen. Wenn du unbedingt noch mehr wissen willst, kann ich dir die Seite batteryuniversity.com empfehlen.
Ich bändige das Editorial Team. Hauptberuflicher Schreiberling, nebenberuflicher Papa. Mich interessieren Technik, Computer und HiFi. Ich fahre bei jedem Wetter Velo und bin meistens gut gelaunt.
Interessantes aus der Welt der Produkte, Blicke hinter die Kulissen von Herstellern und Portraits von interessanten Menschen.
Alle anzeigen